Molto più che in altri mammiferi, nei bovini la tempestiva somministrazione di colostro è fondamentale per il trasferimento del corredo immunitario materno al neonato.
Infatti, a differenza di altre specie, la placenta della vacca è di tipo cotiledonare sindesmocoriale e non consente uno scambio diretto di determinate sostanze tra il sangue materno e il sangue fetale [1]. Tra queste sostanze troviamo anche gli anticorpi, più precisamente le immunoglobuline G (IgG), A (IgA) e M (IgM). Queste proteine specifiche costituiscono il corredo immunitario dell’animale e in certi mammiferi, come l’uomo, si trasferiscono dalla madre al feto nel corso della gravidanza e durante l’allattamento.
Nella specie bovina, i vitelli alla nascita sono normalmente agammaglobulinemici e quindi l’acquisizione dell’immunità avviene attraverso l’ingestione di colostro nelle prime ore di vita; tale trasferimento di immunità si definisce “passivo” [1]. Nelle aziende commerciali spesso si riscontrano vitelli in cui, per diverse ragioni, tale trasferimento non avviene correttamente. Studi recenti riportano che mediamente circa il 10% dei vitelli sono a rischio di infezione e maggiormente esposti a patologie in quanto caratterizzati dalla condizione di “fallimento del trasferimento dell’immunità passiva” (Failure of Passive Transfer, FPT). In questi vitelli la concentrazione ematica di IgG a 24 ore dalla nascita è al di sotto del valore minimo (10 g/L).
In linea di principio, si raccomandano poche e semplici regole pratiche al fine di ridurre l’incidenza di FPT, riassunte nell’acronimo “4Q“: quality (qualità), quantity (quantità), quickness (tempestività) e quota (scorte). Le immunoglobuline rappresentano oltre il 75% delle proteine totali del colostro, specialmente se secreto nelle prime ore dopo il parto, e la frazione maggiormente presente e responsabile dell’acquisizione dell’immunità passiva è quella dalle IgG.
Per questo motivo, in ambito veterinario e zootecnico, il parametro di riferimento per determinare la qualità del colostro da somministrare ai vitelli è la concentrazione di IgG. Stando alla letteratura, il valore soglia che discrimina un colostro di qualità sufficiente da un colostro di qualità insufficiente nei bovini è 50 g/L di IgG [1].
La concentrazione di IgG è massima nel cosiddetto primo colostro, ossia quello prodotto nelle prime ore post-parto (Figura 1), e tende successivamente a diminuire fino a raggiungere concentrazioni inferiori a 10 g/L già a partire dalla quarta mungitura.
Figura 1 – Concentrazione di IgG ematica e colostrale e permeabilità intestinale nel vitello dopo la nascita.
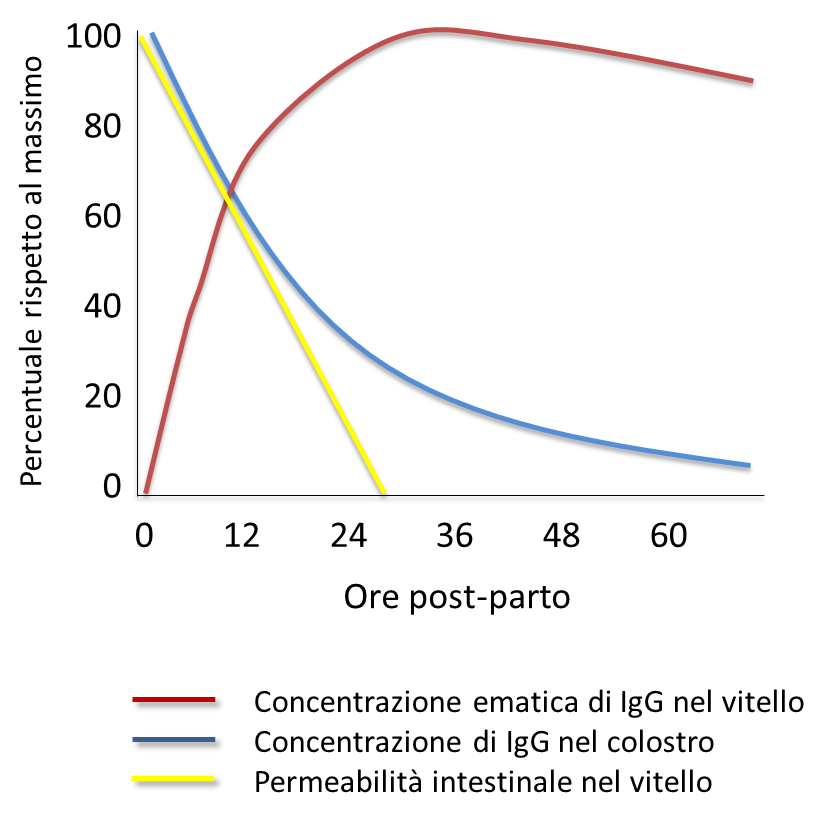
Numerosi studi sono concordi nel riportare che sia necessaria l’ingestione di almeno 4 L di colostro nelle prime 12 ore di vita del vitello, anche suddivisi in più pasti, al fine di ridurre il rischio di FPT. Questa finestra temporale piuttosto ristretta è legata a ragioni fisiologiche intrinseche del vitello; infatti, la massima capacità di assorbimento a livello intestinale si osserva alla nascita, per poi diminuire progressivamente, fino ad esaurirsi a 24 ore di vita (Figura 1).
La somministrazione tempestiva di colostro è quindi fondamentale e qualora la madre sia impossibilitata a produrre quantità sufficienti di tale secreto, è necessario intervenire con del colostro prodotto da altre vacche (congelato o fresco) o in polvere. La pratica di conservare (-20°C) il colostro per far fronte a situazioni di emergenza rientra tra le buone pratiche di gestione della vitellaia [1]. Numerose aziende per ridurre l’incidenza della FPT si sono equipaggiate con una banca del colostro interna.
Laddove presente, si utilizza uno strumento indiretto per la valutazione della qualità del colostro da conservare. Tra gli strumenti più diffusi negli allevamenti e commercialmente disponibili a costi abbordabili, troviamo il colostrometro e il refrattometro, i quali forniscono una stima indiretta ed approssimativa del livello di IgG (qualità) del campione.
L’analisi di riferimento (gold standard) per la determinazione della concentrazione di immunoglobuline colostrali è l’immunodiffusione radiale (RID), analisi che richiede kit specifici e personale qualificato, oltre che specifiche strumentazioni di laboratorio. La RID risulta quindi inadatta per analisi qualitative e quantitative di routine in azienda [1], mentre risulta ancora poco esplorata l’abilità dell’infrarosso nel predire la composizione e le caratteristiche qualitative di tale matrice [2].
In una recente prova sperimentale coordinata dal team del Prof. De Marchi (Università di Padova), è stato campionato il colostro entro 6 ore dal parto in 678 bovine di razza Frisona in un arco temporale di 14 mesi, tra marzo 2019 e maggio 2020. Le bovine, di diverso ordine di parto, erano dislocate in 9 aziende commerciali del Triveneto [1]. In ogni campione di colostro, dopo scongelamento, è stato acquisito lo spettro grazie a specifiche strumentazioni che operano nel vicino infrarosso (NIR) e sono state contemporaneamente determinate anche le concentrazioni di IgG, IgA e IgM usando appositi kit RID [1]. Ciò ha consentito di studiare le fonti di variazione dei caratteri RID [1] e di sviluppare modelli di predizione per le immunoglobuline colostrali, in modo da stimarne con una certa accuratezza le concentrazioni, by-passando le onerose analisi RID e sfruttando un volume molto limitato (<10 mL) di colostro [2].
In generale, i valori medi, minimi e massimi delle tre frazioni immunoglobuliniche (Tabella 1) sono risultati in linea con quanto riportato in letteratura per il colostro bovino prodotto nelle prime mungiture [1].
| Carattere | Media | Coefficiente di variazione, % | Minimo | Massimo |
|---|---|---|---|---|
| IgG, g/L | 91.31 | 39.6 | 0.68 | 216.7 |
| IgA, g/L | 4.2 | 63.4 | 0.13 | 22.14 |
| IgM, g/L | 5.05 | 48.5 | 0.18 | 14.01 |
| Ig TOTALI | 105.99 | 34.7 | 20.37 | 228.59 |
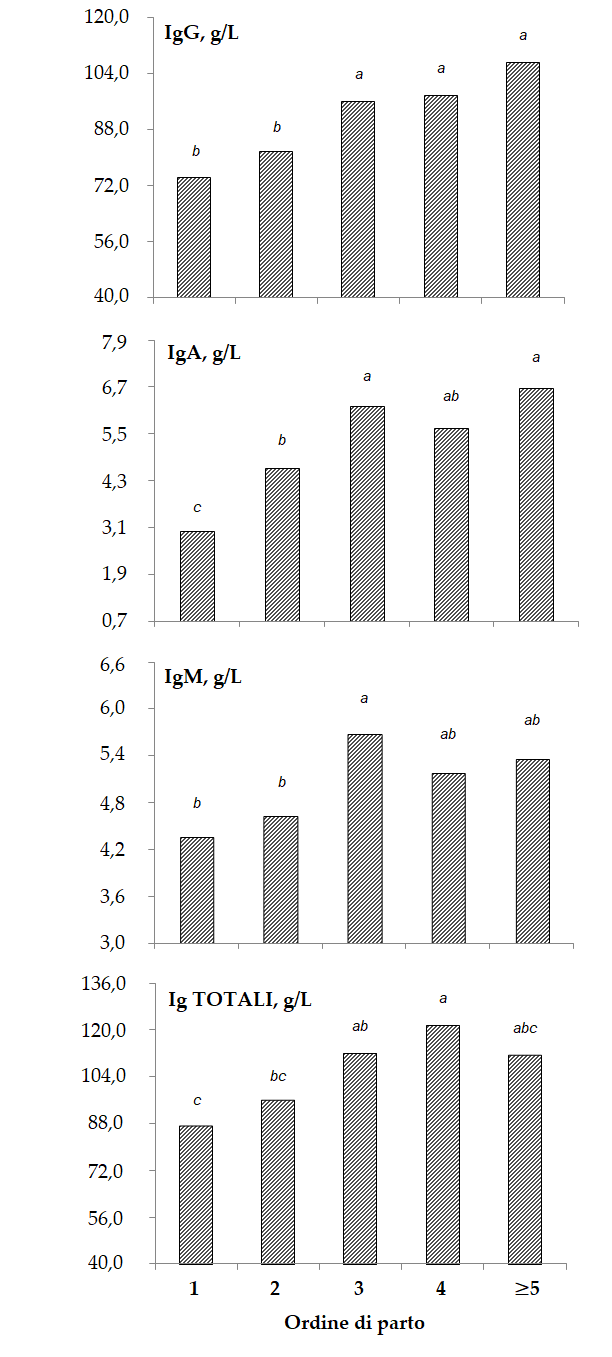
L’analisi della varianza ha mostrato come le immunoglobuline siano risultate maggiormente concentrate nel colostro delle vacche dal terzo ordine di parto in poi [1]; in particolare, per quanto riguarda la concentrazione di IgG, il colostro delle vacche primipare non risultava significativamente diverso da quello delle secondipare (Figura 2).
Figura 2 – Medie stimate di IgG, IgA, IgM e loro somma (Ig TOTALI) per l’effetto ordine di parto; lettere diverse denotano stime significativamente diverse fra loro (P<0,05) [1].
Confrontando le medie stimate di IgG, IgA e IgM per le 9 aziende coinvolte nello studio, si è riscontrato un certo pattern sovrapponibile (Figura 3), ad indicare che sussiste una correlazione positiva a livello di colostro medio aziendale tra le tre frazioni [1].
A causa della scarsa concentrazione di IgA e IgM nel colostro bovino, i relativi modelli di predizione NIR sono risultati insoddisfacenti dal punto di vista delle performance di predizione in validazione esterna (Tabella 2) [2].
Nonostante ciò, la concentrazione di IgG predetta attraverso la tecnologia NIR è risultata accurata (Tabella 2) con un coefficiente di determinazione superiore a 0,80 in validazione esterna. Ciò significa che il modello sviluppato per il parametro cardine legato alla definizione della qualità del colostro, cioè IgG, ha mostrato performance buone e che la predizione ottenuta a partire dagli spettri NIR è sufficientemente accurata per un’acquisizione di fenotipi su ampia scala [2].
Figura 3 – Medie stimate di IgG, IgA, IgM e loro somma (Ig TOTALI) per l’effetto azienda (P<0,01). [1]
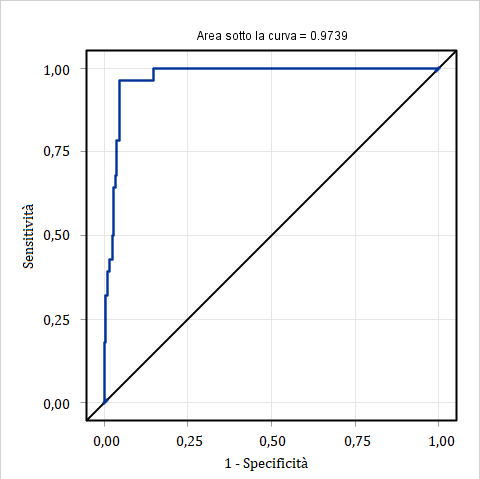
Inoltre, si è visto che la concentrazione di IgG predetta attraverso la tecnologia NIR è in grado di identificare in maniera ottimale quei campioni originariamente classificati come di qualità insufficiente, ovvero che mostravano concentrazione di IgG misurata con gold standard RID inferiore a 50 g/L (Figura 4).
Tabella 2 – Performance1 dei modelli di predizione NIR. [2]
| Carattere | LV | Validazione interna (cross) | Validazione esterna | |||||
|---|---|---|---|---|---|---|---|---|
| RMSE | R2 | RMSE | R2 | Errore | Pendenza | RPD | ||
| IgG, g/L | 19 | 8.77 | 0.92 | 13.28 | 0.83 | 12.42 | 0.86 | 2.45 |
| IgA, g/L | 15 | 1.33 | 0.67 | 2.02 | 0.43 | 2.18 | 0.57 | 1.28 |
| IgM, g/L | 15 | 1.68 | 0.54 | 1.81 | 0.37 | 2.7 | 0.45 | 1.24 |
1LV = numero di variabili latenti utilizzate; RMSE = errore quadratico medio; R2 = coefficiente di determinazione; RPD = deviazione residua in predizione.
L’area al di sotto della curva (AUC) ottenuta sviluppando la curva ROC è risultata pari a 0,9739 (Figura 4), valore che indica un’eccellente accuratezza diagnostica e che dimostra come sia pressoché minimo l’errore in termini di sensibilità, specificità e numero di falsi positivi e di falsi negativi.
Considerando le performance dei modelli (Tabella 2), si evince quindi che la tecnologia NIR può essere sfruttata per la determinazione puntuale di IgG e non delle altre due frazioni. Tuttavia, la tecnologia NIR consente l’acquisizione di fenotipi, seppur meno accurati, anche relativi a IgA e IgM, con un costo/sforzo addizionale nullo. Per questo motivo, si è voluto approfondire la correlazione genetica tra il carattere “predetto” (IgG_NIR) e il carattere “misurato” attraverso gold standard RID (IgG_RID) sfruttando il database raccolto nel corso della prova sperimentale [3].
Figura 4 – Curva ROC (blu) per la valutazione dell’accuratezza diagnostica di IgG colostrale predetto da spettro NIR.
Inoltre, sono state successivamente stimate le correlazioni genetiche con le altre due frazioni misurate sui campioni a disposizione: IgA_RID ed IgM_RID [3]. È emerso che il carattere di maggiore interesse (IgG_RID) è fortemente correlato, geneticamente e fenotipicamente, con tutte le frazioni immunoglobuliniche predette (IgG_NIR, IgA_NIR e IgM_NIR), con coefficienti di correlazione tra 0,72 e 0,99 (Tabella 3). In particolare, la correlazione genetica entro IgG, ossia tra IgG_RID e IgG_NIR, è risultata significativa e pari a 0,85, suggerendo che è possibile sfruttare le predizioni NIR per scopi genetici in quanto la risposta correlata in caso di selezione indiretta sarebbe favorevole e si tradurrebbe in un’efficiente risposta alla selezione [3]. A tal proposito, sono state eseguite delle simulazioni per quantificare la risposta alla selezione qualora si attuasse una selezione per il carattere obiettivo di selezione, IgG_RID (Tabella 4). Nel caso di selezione diretta, la risposta annua ottenibile sarebbe pari a +2,823 g/L, molto simile o addirittura superiore a quella ottenibile con la selezione indiretta considerando simultaneamente nell’indice tutte le tre frazioni predette attraverso NIR (Tabella 4).
Tabella 3 – Valori minimo e valore massimo stimati per l’ereditabilità (diagonale) e stima delle correlazioni genetiche (sopra diagonale) e fenotipiche (sotto diagonale). [3]
| Carattere | IgG_RID | IgA_RID | IgM_RID | IgG_NIR | IgA_NIR | IgM_NIR |
|---|---|---|---|---|---|---|
| IgG_RID | 0,06 – 0,17 | 0.22 | 0.4 | 0,85* | 0.99 | 0,74* |
| IgA_RID | 0,55* | 0,08 – 0,18 | 0.14 | Non stimabile | 0.12 | 0.26 |
| IgM_RID | 0,60* | 0,52* | 0,22 – 0,25 | -0.05 | 0.26 | 0.52 |
| IgG_NIR | 0,77* | 0,53* | 0,55* | 0,06 – 0,15 | 0.9 | 0,76* |
| IgA_NIR | 0,72* | 0,55* | 0,57* | 0,74* | 0,09 – 0,20 | 0,98* |
| IgM_NIR | 0,78* | 0,57* | 0,58* | 0,82* | 0,78* | 0,20 – 0,25 |
*P<0,05.
Infatti, la risposta sarebbe pari a +2,782 g/L e a +3,141 g/L nel caso in cui ci si focalizzasse rispettivamente su tori con accuratezza dell’indice intorno a 0,70 (=30 figlie) e 0,85 (=120 figlie). Al giorno d’oggi, parte del progresso genetico è dato dalla selezione genomica; in questo contesto, sarebbe auspicabile la raccolta di fenotipi NIR relativi al colostro all’interno della reference population.
Tabella 4 – Risposta alla selezione annua (Ry) nel carattere obiettivo di selezione1 per i diversi scenari simulati. [3]
| Scenario | Criterio di selezione | Tori | Vacche | Ry | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| IgG_RID | IgG_NIR | IgA_NIR | IgM_NIR | n | Rg | rIH | PP | n | Rg | rIH | ||
| Base | ✓ | 30 | 9.73 | 0.73 | 1 | 3 | 6.31 | 0.48 | 2.823 | |||
| Alternativo | ||||||||||||
| I | ✓ | 120 | 12.03 | 0.91 | 1 | 3 | 6.31 | 0.48 | 3.228 | |||
| II | ✓ | 30 | 7.23 | 0.54 | 1 | 3 | 4.29 | 0.33 | 2.028 | |||
| III | ✓ | 120 | 9.7 | 0.73 | 1 | 3 | 4.29 | 0.33 | 2.462 | |||
| IV | ✓ | ✓ | ✓ | 30 | 9.37 | 0.71 | 1 | 3 | 6.436 | 0.486 | 2.782 | |
| V | ✓ | ✓ | ✓ | 120 | 11.41 | 0.86 | 1 | 3 | 6.436 | 0.486 | 3.141 |
1IgG_RID (g/L).
n = numero di figlie considerate; Rg = risposta alla selezione per generazione (g/L); rIH = accuratezza dell’indice; PP = numero di fenotipi relativi a performance proprie; Ry = risposta alla selezione per anno (g/L).
Infine, la presenza di fenotipi raccolti su un numero sufficiente di individui genotipizzati consentirà di svolgere studi di associazione genome-wide e di portare alla luce i geni candidati responsabili della variabilità della concentrazione di IgG nel colostro bovino.
Oltre alle predizioni NIR, anche l’indice di rifrazione misurato con il rifrattometro (BRIX) è risultato uno strumento indiretto promettente e ha mostrato variabilità tra ordini di parto simili alle 3 immunoglobuline (Figura 5) [4].
Figura 5 – Medie stimate di BRIX per l’effetto ordine di parto; stime significativamente diverse fra loro sono indicate con ***(P<0.001) e †(P<0.10) [4].
Si è dimostrato che i valori BRIX sono favorevolmente correlati con IgG_RID, IgA_RID e IgM_RID anche dal punto di vista genetico (Tabella 5). Inoltre, come osservato per IgG_NIR, anche l’accuratezza diagnostica di BRIX risultava ottimale, con AUC pari a 0,90. Ciò conferma che il rifrattometro è uno strumento valido per la valutazione del colostro in azienda.
Tabella 5 – Correlazioni genetiche e fenotipiche, con relativi errori standard, del carattere BRIX con le frazioni immunoglobuliniche determinate con il metodo di riferimento (RID). [4]
| Carattere | Correlazione fenotipica | Correlazione genetica |
|---|---|---|
| IgG_RID | 0,78* (0,02) | 0,91* (0,14) |
| IgA_RID | 0,57* (0,03) | 0,57* (0,35) |
| IgM_RID | 0,61* (0,03) | 0,71* (0,23) |
*P<0,05
Coautori
Giulio Visentin (DIMEVET, Università di Bologna), Marco Franzoi (DAFNAE, Università di Padova), Mauro Penasa (DAFNAE, Università di Padova) e Massimo De Marchi (DAFNAE, Università di Padova)
Sinossi di:
[1] Costa et al., 2021. Variation of immunoglobulins G, A, and M and bovine serum albumin concentration in Holstein cow colostrum. Animal.
[2] Franzoi et al., 2022. Effectiveness of visible – near infrared spectroscopy coupled with simulated annealing partial least squares analysis to predict immunoglobulins G, A, and M concentration in bovine colostrum. Food Chemistry.
[3] Costa et al., 2021. The concentrations of immunoglobulins in bovine colostrum determined by the gold standard method are genetically correlated with their near-infrared prediction. Genetics Selection Evolution. 53:87. 10.1186/s12711-021-
[4] Costa et al., sottomesso. The refractive index of colostrum as a proxy of immunoglobulins for selective breeding in Holstein cows. Journal of Animal Breeding and Genetics.