Il periparto, periodo critico del moderno allevamento della bovina da latte
Il parto e l’avvio di una nuova lattazione impongono sollecitazioni fisiologiche tremende ai meccanismi omeostatici della bovina da latte (Bertoni e Trevisi, 1997; Goff e Horst, 1997). Quale risultato, la transizione dallo stato di gravidanza e di non lattazione a quello di non gravidanza e lattazione si traduce sovente in un’esperienza disastrosa per la bovina (Drackley, 1999). Questo è confermato dall’incidenza delle affezioni che raggiunge il suo acme proprio nel periodo di transizione (fase che include le ultime 3 settimane di gravidanza e le prime 3 di lattazione) e nel periodo immediatamente successivo. Il rischio è elevato tanto per le forme tipiche del periparto (ritenzione di placenta, collasso puerperale, acetonemia o chetosi primaria, steatosi epatica, metrite, dislocazione abomasale), quanto per le altre affezioni (mastiti, zoppie, turbe intestinali, virosi ecc.). Si stima che il 75% delle affezioni metaboliche ed infettive delle bovine da latte si verifichi nel primo mese di lattazione (Leblanc et al., 2006) e che il 50% delle lattazioni sia associato ad almeno una dismetabolia nel periparto (Galligan e Ferguson, 1996). Tuttavia, questi dati celano una condizione ancor più grave considerato che, in un’ipotetica distribuzione della popolazione secondo le condizioni di salute, il picco di frequenza di una patologia è proporzionale alle forme sub-cliniche. Nel periodo di transizione dunque, la maggior parte delle bovine è colpita da affezioni, ma molte non presentano manifestazioni cliniche (Bertoni et al., 2008). Ne deriva che la prevenzione delle affezioni è la strada maestra per il successo dell’intera lattazione e, quindi, della carriera produttiva della lattifera.
La transizione non è tuttavia, una condizione che determina automaticamente la comparsa di affezioni, rappresenta semplicemente un fattore di rischio. Jourdan e Fourdraine (1993), esaminando i 61 allevamenti statunitensi più produttivi dell’epoca, avevano riscontrato un’ampia variabilità della frequenza delle principali affezioni del periparto, oscillante dall’assenza a percentuali a doppia cifra. Questa elevata variabilità supporta la compatibilità tra le alte performance produttive con buone condizioni di salute, a condizione che si adottino opportune strategie gestionali in grado di minimizzare la presenza di ogni patologia e disordine metabolico. A questo riguardo occorre ricordare che ogni stressore può giocare un ruolo importante, da quelli psicologici a quelli infettivi riferibili a patogeni opportunisti (Chase, 1996).
Inquadramento concettuale
I fenomeni sopra descritti devono essere riportati all’interno di una cornice concettuale coerente, che consenta un loro corretto inquadramento. Il raggiungimento di alti livelli di produzione in zootecnia determina una maggiore difficoltà degli animali ad adattarsi all’ambiente. Questo si traduce in aumento dei tassi di rimonta, riduzione della speranza di vita, una maggiore frequenza di malattie variegate e multifattoriali, da cui un maggior uso di farmaci veterinari. Nel caso delle bovine da latte l’insorgenza di malattie condizionate è facilitata dalla presenza di fenotipi animali ad alta produzione che richiedono elevate competenze tecniche e gestionali, strutture adeguate e controlli intensivi dell’allevatore, in rapporto ad una ridotta capacità di adattamento a condizioni sub-ottimali dell’ambiente. Tale concetto riguarda anche l’attuale bovina da latte Frisona ad alta produzione, che presenta un potenziale produttivo pari o superiore a 10.000 kg di latte / lattazione, che è stato significativamente correlato a maggiori frequenze di chetosi, mastite e zoppie (Ingvartsen et al., 2003), nonché a tassi di rimonta elevati (>30%) proprio in ragione delle malattie del periparto. Così, le bovine vive a 48 mesi di vita nel nord-est USA sono passate dall’ 80% nel 1957 al 13% nel 2002; nelle stesse aziende e periodo di osservazione l’intervallo interparto medio è salito da 13 a 15,5 mesi (Oltenacu and Broom, 2010). Va tuttavia sottolineato che i meccanismi biologici sottostanti a tali fenomeni sono solo in parte noti (Oltenacu and Broom, 2010).
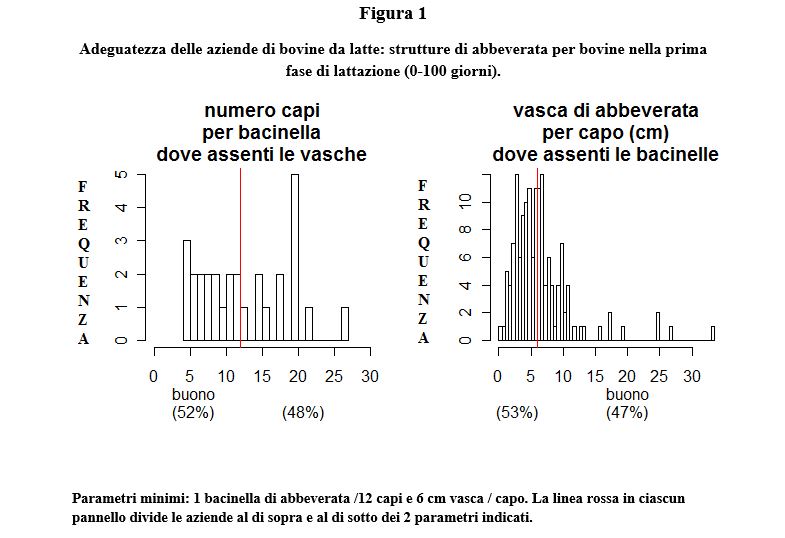
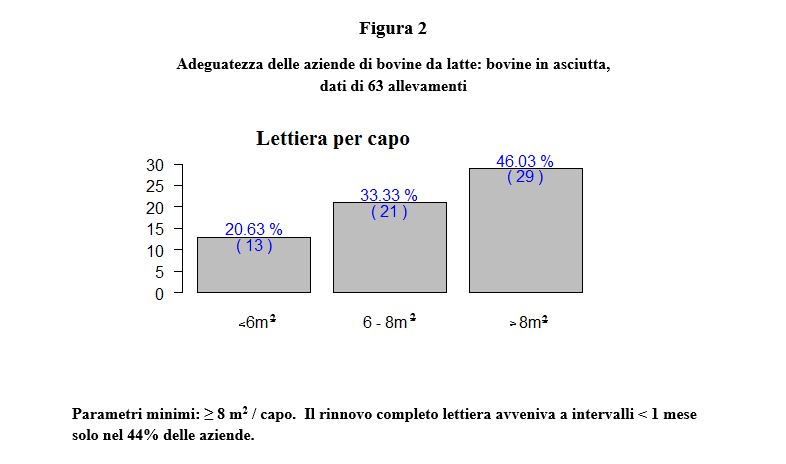
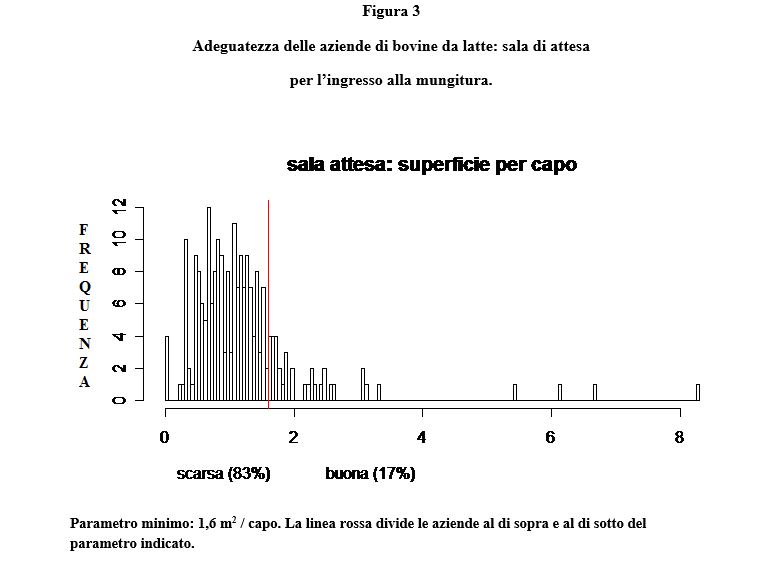
Tale tendenza generale è riscontrabile da tempo anche in Italia. Nel 2010 è stata registrata una produzione media di 9.075 kg, con contenuto medio pari a 3.64% e 3.31%, rispettivamente per grasso e proteina, su 651.489 lattazioni di bovine Frisone (dati ANAFI). Questi dati dimostrano un netto miglioramento quantitativo e qualitativo della produzione e devono essere opportunamente capiti ed interpretati alla luce di altri fenomeni. In effetti, l’analisi comparativa di aziende a diverso profilo produttivo e stato sanitario dimostra che l’aumento della produzione di latte ottenuta per selezione genetica non è di per sé causa di riduzione del benessere e della sanità animale, bensì un fattore cui una parte della popolazione animale non è in grado di rispondere con strategie di adattamento adeguate, specie quando sono presenti deficit strutturali di stabulazione e conduzione aziendale. Tali deficit sono purtroppo ancora diffusi nei nostri allevamenti. Uno studio di campo condotto su 231 aziende delle provincie di Milano, Lodi, Pavia, Cremona (Relazione finale progetto di ricerca MINSAL 01/03 “Standardizzazione e verifica sperimentale dei parametri clinici, comportamentali e laboratoristici di benessere nei bovini da carne e da latte”) aveva infatti rilevato importanti deficit strutturali in molte aziende relativi in particolare: alla abbeverata delle bovine nella prime fasi di lattazione (Figura 1), allo spazio a disposizione su lettiera permanente delle bovine in asciutta (Figura 2), allo spazio a disposizione nella stalla di attesa per la mungitura (Figura 3). Sebbene vi sia la tendenza al miglioramento strutturale degli allevamenti, i problemi evidenziati alcuni anni fa, purtroppo, persistono, anche per le ricorrenti dinamiche di compressione del prezzo del latte che rallentano gli investimenti. Per tale motivo, un divario evidente può sorgere tra le esigenze delle bovine da latte ad alta produzione ed ambiente in cui queste vengono allevate. Questa fondamentale condizione di rischio può coesistere con elevati livelli di prestazioni produttive. Queste sono compromesse da malattie clinicamente conclamate e/o gravi disfunzioni metaboliche; entrambi i casi portano allo stesso risultato: rimozione precoce degli animali dal processo produttivo e aumento complessivo dei tassi di rimonta.
Gli eventi di malattia trovano la loro origine nella strategia di risposta agli stressori ambientali sopra menzionati, basata su processi flogistici complessi, variegati, diversamente modulati per intensità e durata temporale. Possono essere così messi in evidenza nel periparto diversi parametri flogistici, quali inversione della formula leucocitaria, monocitosi, alterazione del rapporto albumine/globuline, risposta di fase acuta positiva (con aumento di aptoglobina, ceruloplasmina) e negativa (con riduzione di albumina, proteine di trasporto della vitamina A e del colesterolo, paraoxonasi), bilirubina, citochine infiammatorie come interleuchina (IL)-6 e IL-1 beta, proteine dello shock termico (HSP), metaboliti reattivi dell’ossigeno (ROMs). Tali aspetti sono legati all’attivazione del sistema immunitario innato. Al di là dei diversi aspetti messi in evidenza nei laboratori, la risposta flogistica degli animali persegue la medesima finalità: attuare un intervento protettivo contro noxae diverse per restaurare l’omeostasi dell’ospite. Tali noxae si sovrappongono a eventi fisiologici imponenti, che richiedono impegnativi aggiustamenti omeostatici nel periparto (gravidanza, cambiamenti alimentari e metabolici, riformazione dell’epitelio secernente della ghiandola mammaria, cambiamenti di ambiente e gruppi sociali). La risposta flogistica conseguente raggiunge normalmente il proprio picco con il progredire dello stress metabolico correlato al bilancio energetico negativo innescato dalla lattazione. Ciò non deve far dimenticare che l’azione degli stressori ambientali si esercita sulle bovine ben prima dell’avvio della lattazione e che tale esposizione precoce (specie nel periodo di asciutta) può condizionare la successiva risposta allo stress produttivo. La correlazione tra stress metabolico e insorgenza di malattia (mastite) sarebbe provata sulla base della somministrazione sperimentale di ormone della crescita nelle bovine (Report on Animal Welfare Aspects of the Use of Bovine Somatotrophin, http://ec.europa.eu/food/fs/sc/scah/out21_en.pdf), anche se tale assunto non raccoglie consensi unanimi nella comunità scientifica, specie negli USA. Come spiegare la correlazione tra impatto degli stressori ambientali e metabolici ed attivazione del sistema immunitario innato? La risposta a questo fondamentale quesito è stata fornita dalla comunità scientifica nel corso degli ultimi anni. In realtà, il sistema immunitario innato è in grado di rispondere tanto ai comuni agenti microbici (stressori infettivi), quanto a stressori non infettivi (alte / basse temperature, distruttori endocrini, stress ossidativo, ipossia, stress psichico, danni tissutali, obesità, ecc.). La base molecolare comune di stressori infettivi e non-infettivi è rappresentata dalla formazione di prodotti legati al danneggiamento tissutale (Damage-Associated Molecular Patterns, DAMPs) quali sali (potassio extracellulare), ATP, ROMs, acido urico, DNA mitocondriale (Gallo and Gallucci, 2012). A tali componenti si aggiunge la formazione di neo-antigeni sulla superficie cellulare, denominati “antigeni da stress”, riconosciuti da cellule linfoidi (linfociti T e cellule Natural Killer). Inoltre, stress ossidativo e risposta infiammatoria si stimolano a vicenda, con indubbie ricadute negative sulla capacità di controllo di tali risposte. In sostanza, in una condizione di omeostasi, il soggetto sano è costantemente esposto a stimoli flogistici di varia natura a bassissime concentrazioni (endotossine o LPS, acidi nucleici, NEFA, DAMPs, ecc.), che determinano una condizione di allerta del sistema immunitario innato (cosiddetta “infiammazione omeostatica”). Allorquando tali stimoli superano determinati livelli soglia (concentrazione e durata), si può passare ad una condizione di risposta flogistica irreversibile, correlata a danni tissutali e malattia. Nella bovina da latte ad alta produzione, tali fenomeni si accompagnano a una condizione generale di ridotta competenza immunitaria nel periparto, correlata a ridotta concentrazione di L-glutammina, glucosio e calcio, nonché presenza di corpi chetonici e NEFA (Ingvartsen, Moyes, 2013). Tale ridotta competenza immunitaria si estrinseca a sua volta nella riduzione di fondamentali processi effettoriali della risposta immunitaria innata ed adattiva (specifica) quali chemiotassi, diapedesi, risposta ossidativa dei granulociti neutrofili, proliferazione linfocitaria, secrezione di anticorpi IgM, produzione di citochine, presentazione di antigeni.
Tali condizioni di alterata reattività immunitaria e alterato controllo della risposta flogistica sono indubbiamente connesse all’aumentata incidenza di malattie e ad un maggiore impiego di farmaci veterinari, che determina a sua volta problemi per i livelli generali di sicurezza alimentare. A questo proposito, la correlazione critica tra benessere degli animali, salute animale e sicurezza alimentare può essere definita dalla seguente catena di eventi: stress cronico → immunosoppressione → malattie condizionate → maggiore necessità di antibiotici → problemi di sicurezza alimentare. In pratica, una sovrastimolazione dei meccanismi fisiologici di omeostasi può indurre uno stato di immunosoppressione, che a sua volta predispone a insorgenza di malattia. Le funzioni immunitarie rappresentano pertanto un sistema “reporter” cruciale del processo di adattamento ambientale. I modelli di stress cronico sono molto più pertinenti a questo concetto di base dei modelli di stress acuto, in quanto gli effetti dello stress sul sistema immunitario sono generalmente adattativi a breve e dannosi nel medio e lungo periodo. I due circuiti principali, “stimoli psico-sensitivi / risposta comportamentale” e “stimoli antigenici / risposta immunitaria” sono in realtà sottosistemi di un complesso integrato unitario volto a fornire le condizioni ottimali per la sopravvivenza dell’ospite e l’adattamento. Sulla base di tali concetti, si possono adottare saggi immunologici che evidenziano fasi pre-cliniche dei problemi di adattamento e consentono possibili trattamenti farmacologici precoci e sicuramente più efficaci. Tali saggi possono pertanto giocare un ruolo importante, complementare e sinergico con gli approcci attuali basati su osservazioni dello stato clinico e delle performance produttive.
I limiti attuali nella gestione del periodo di transizione
Nonostante la grande attenzione che si presta alla gestione di questa fase critica, si continua a mantenere una visione sostanzialmente distorta del problema. Nella pratica infatti, la massima considerazione è dedicata alla fase successiva al parto, mentre generalmente si trascura quella precedente, in quanto ritenuta priva di rischi per la ridottissima presenza di affezioni clinicamente rilevabili. La stranezza è che ciò avvenga nonostante si convenga che la lattazione inizi con il primo giorno di asciutta (Bertoni e Trevisi, 1997) e che molte delle affezioni peripartali trovino spiegazione in errori pregressi (alimentari, prevenzione sanitaria, densità, movimentazione, ecc.). Tali considerazioni impongono pertanto di rilevare nel periodo di asciutta una serie di parametri già routinariamente usati nel postparto, come lo stato di ingrassamento (Body Condition Score, BCS), l’appetito/ruminazione, l’attività motoria, la temperatura corporea. Questo deficit di attenzione in asciutta è la principale causa di una intempestiva rilevazione di anomalie, che possono poi sfociare in ben più gravi affezioni. Di seguito verranno illustrati i principali indicatori, attualmente disponibili, per il tempestivo riconoscimento delle bovine “problema” e alcuni suggerimenti per il loro corretto impiego.
Ingestione di alimenti (dry matter intake = DMI)
Il calo di DMI nelle ultime settimane di gestazione è considerato da molti, ricercatori ed allevatori, un evento ineluttabile (Grummer, 1993). Tuttavia esiste un’ampia variabilità di comportamenti alimentari delle bovine a termine gestazione (Trevisi et al., 2002), schematicamente riassumibili in 3 situazioni: calo limitato al solo giorno del parto, calo nell’ultima settimana di gravidanza e calo precoce (da 2-3 settimane prima del parto). Le bovine di quest’ultimo gruppo sono caratterizzate dalla più alta incidenza di inappetenza e stati febbrili (>39,5°C) ante-parto, eventi non sempre tra loro correlati e, soprattutto, raramente associati ad altri sintomi clinici. Tali risultati evidenziano la correlazione tra calo di ingestione ante parto e comparsa di affezioni sub-cliniche ma, soprattutto, l’inesattezza dell’assioma sull’ineluttabilità del calo di ingestione in fase di gravidanza avanzata. Infatti quanto più elevata è l’ingestione prima del parto quanto più rapido è il suo aumento nel 1° mese di lattazione, il che conferma l’osservazione di Grummer (1995) che aveva trovato una correlazione positiva tra il livello di DMI al 1° ed al 21° giorno di lattazione. Pertanto, la riduzione del DMI nel pre-parto può essere utilizzato come un precoce indicatore della presenza di un evento anomalo. In allevamento, dove la misurazione individuale del DMI è praticamente impossibile ad oggi, ci si deve accontentare di indicazioni sull’ingestione media di gruppo. Un frequente monitoraggio potrebbe consentire l’individuazione di oscillazioni anomale e, quindi, segnalare la presenza di soggetti “problema”. Tuttavia altri indicatori correlati all’ingestione potrebbero rappresentare una valida e più efficace alternativa alla misurazione del DMI. Il più promettente è costituito dalla misura della frequenza degli atti ruminativi (Schirmann et al., 2009), che si riduce in presenza di affezioni. Da qualche anno, è stato introdotto in commercio un dispositivo in grado di misurare tale attività. Il suo impiego negli allevamenti commerciali appare assai promettente, come anche noi abbiamo potuto dimostrare (Soriani et al., 2012).
Body Condition Score
La valutazione delle riserve corporee con un metodo semplice, rapido, agile ed economico, seppur soggettivo, è uno strumento utile per valutare l’entità della mobilizzazione delle riserve nel periparto (Bertoni e Trevisi, 1992). Il calo di BCS postpartale è fisiologico entro certi limiti (0,5-0,8 punti in relazione al metodo di valutazione utilizzato), ed è correlato al livello produttivo. Tuttavia, l’entità della lipomobilizzazione (e del conseguente calo di BCS) è anche fortemente correlata alla presenza di malattie. In questo caso, una quota rilevante delle riserve è dedicata al funzionamento del sistema immunitario (Elsasser et al., 2000), fatto che determina un aumento delle spese di mantenimento. Questi aumentati costi energetici (e proteici) si verificano anche in presenza di affezioni subcliniche (Trevisi et al., 2007). Il risultato finale è che oltre un certo grado di lipomobilizzazione (-0,75 punti di BCS) si verifica una riduzione della fertilità (Formigoni e Trevisi, 2003). Quindi la stima del BCS al parto e nei mesi successivi è un utile strumento di verifica gestionale per monitorare l’entità e la durata del deficit energetico e per suggerire opportuni interventi correttivi. Altra indicazione di estrema importanza prima del parto è quella di monitorare la condizione corporea ed evitare eccessivi stati di ingrassamento (BCS > 3). Le bovine “grasse” infatti rispondono con una più intensa lipomobilizzazione dopo il parto, più elevate concentrazioni di NEFA e maggiore tendenza a chetosi clinica e sub-clinica. In asciutta non si dovrebbero verificare importanti variazioni delle riserve, anche se in generale si ritiene accettabile un lievissimo calo nelle ultime 2 settimane di gestazione. Situazioni differenti (in particolare di calo più marcato) suggeriscono condizioni di gestione anomala (es. carenze di energia nella razione, presenza di affezioni sub-cliniche, ecc.). La valutazione del BCS tuttavia, ha molte limitazioni (es. esistono vari metodi, si tratta comunque di metodi soggettivi, mancano sistemi di standardizzazione), per cui si tratta di un dato che necessita di essere confermato con altri indicatori (es. metabolici). Nel prossimo futuro, probabilmente, si disporrà di sistemi più oggettivi per la valutazione delle riserve adipose, in analogia con quanto fatto in campo umano (es. impedenza elettrica), e questa determinazione potrà assumere un significato più rilevante. Allo stato attuale il BCS resta uno strumento utile per segnalare situazioni inadeguate, ma certamente non è tra gli indicatori più “tempestivi”.
Temperatura corporea
La temperatura corporea è un indicatore sensibile per la rilevazione di patologie che scatenano una risposta infiammatoria. Nonostante ciò la sua rilevazione non è semplice in quanto risente di svariati fattori (es. età, stagione, ora della giornata) ed ha il grave handicap di non essere misurabile in modo affidabile con sistemi automatici online. Sono stati infatti proposti vari sistemi di rilevazione in continuo (es. impianto sottocutaneo, bolo ruminale, sonda vaginale), ma in tutti i casi si restituiscono valori condizionati dall’ambiente in cui la sonda opera. Ad oggi, la misura più precisa resta quella rilevata per via rettale, con il classico termometro, ma richiede tempo. Per cui tale misura è eseguita solo su sospetto, e viene utilizzata come indicatore di conferma più che di allerta. Al contrario, il monitoraggio sistematico della temperatura delle bovine nel post parto è stato suggerito per identificare la presenza di metriti (Smith et al., 2006). Nella nostra esperienza, in cui da tempo abbiamo esteso il monitoraggio all’ultimo mese di gestazione, abbiamo evidenziato stati febbrili (ovvero rialzi termici oltre 39,5°C), anche in assenza di altri sintomi clinici (Trevisi et al., 2002), sia prima che dopo il parto. Tali rialzi termici hanno spesso natura episodica nel preparto e la loro ragione non è ancora stata chiarita. Poiché il trattamento con antinfiammatori è spesso efficace nel riportare la temperatura alla normalità, riteniamo molto probabile che tali rialzi siano correlati al rilascio di citochine pro-infiammatorie, tra i cui effetti esiste quello di aumentare la temperatura corporea. Tuttavia, data la sporadicità di tali episodi, manca ancora la conferma, sebbene abbiamo già avuto modo di segnalare elevati livelli di alcuni di tali mediatori dell’infiammazione (TNF-α, IL-1β e IL-6) nel pre-parto (Trevisi et al., 2009 e 2015), pur in presenza di prelievi ematici non estremamente frequenti in relazione alla rapidità delle modificazioni di tali mediatori (in alcuni casi poche ore). Dopo il parto, i rialzi termici trovano invece spesso un riscontro clinico oggettivo nella comparsa di patologie con complicanze infettive (ritenzioni di placenta, metriti, mastiti, affezioni polmonari ecc.). Il rilievo sistematico della temperatura rende più rapida l’individuazione della patologia, fatto che consente di anticipare la diagnosi e la terapia. Purtroppo, per il limitato tempo a disposizione degli operatori aziendali, tale rilevazione è raramente eseguita con sistematicità e spesso si ricorre alla sua misura solo quando il problema è talmente manifesto (e severo) che diviene una mera conferma della diagnosi. Va per completezza segnalato che nel primo mese di lattazione si osservano casi di difficile interpretazione: episodi in cui la temperatura resta oltre i 39,5°C pur senza una chiara causa infettiva; talune affezioni come la metrite, con complicazioni infettivo-infiammatorie che non mostrano rialzi termici nella prima settimana di lattazione quando i sintomi iniziano ad essere evidenti (Smith et al., 2006).
In generale, la temperatura corporea rilevata per via rettale, possibilmente nella stessa fascia oraria della giornata, appare un efficace e quasi sempre tempestivo indicatore delle affezioni. Il suo inserimento nel monitoraggio routinario del periparto è consigliato (almeno nei 10 giorni precedenti e seguenti il parto). Attualmente appare molto promettente un sistema basato sulla rilevazione della temperatura corporea mediante una sonda inserita in un bolo da mettere nel rumine ed il cui funzionamento è programmato per 5 anni (TempTrack®, DVM Systems Greeley, CO, USA). Restano tuttavia da approfondire almeno due aspetti: i) se trattare farmacologicamente (ad es. con antinfiammatori e/o antibiotici) tutti i casi con rialzi termici, anche in assenza di fatti infettivi clinicamente rilevabili; ii) la definizione di protocolli standard di trattamento da adottare quando è rilevata l’associazione tra rialzo termico e specifica patologia, magari in base alla gravità clinica, che pure andrebbe in qualche modo codificata.
Indici del bilancio energetico negativo (NEB)
Immediatamente dopo il parto, ma talora anche nei giorni precedenti, l’inadeguata ingestione di alimenti rispetto ai fabbisogni (quelli energetici in particolare) determina una più o meno accentuata mobilizzazione delle riserve corporee, con importanti riflessi a livello endocrino-metabolico (Bertoni e Trevisi, 1997; Drackley, 1999). In caso di marcato NEB, il glucosio ematico si riduce, ma il recupero dei valori entro l’intervallo di riferimento (3,3-3,9 mmol/L) è solitamente rapido e avviene anche quando il deficit energetico non è ancora esaurito (Bertoni e Piccioli-Cappelli, 1999). Tra i parametri più utili per individuare le condizioni di NEB figurano gli acidi grassi non esterificati (NEFA) e il β-idrossi-butirrato (BHB). I livelli di NEFA sono proporzionali alla lipomobilizzazione ed oltre 1,0 mmol/L denotano un eccessivo ricorso alle riserve. Il BHB è invece, un indice dell’incapacità epatica di ossidare gli acidi grassi per l’insufficiente disponibilità di energia (glucosio); valori superiori a 1,4 mmol/l sono considerati la soglia della chetosi subclinica. Duffield (2003) riporta tuttavia che già a livelli oltre 1,0 mmol/l aumenta la probabilità di comparsa della dislocazione dell’abomaso. Sempre Duffield (2003), segnala che le bovine con valori oltre 1,4 mmol/l di BHB soffrono di fenomeni mastitici più gravi in caso di infezioni sperimentali. Nelle bovine con problemi di salute, NEFA e BHB presentano livelli più elevati, già nella fase terminale di gravidanza e tale fenomeno si prolunga per alcune settimane dopo il parto. Per una corretta valutazione di tali parametri il prelievo ematico va eseguito il mattino prima del pasto, in quanto i NEFA presentano una marcata diminuzione dopo il pasto stesso mentre il BHB aumenta dopo il pasto (Bertoni et al., 1994).
Indici dell’infiammazione
Il periparto della bovina, anche in assenza di patologie conclamate, è caratterizzato da un quadro ematochimico tipico dell’evento infiammatorio e della conseguente risposta di fase acuta del fegato (Cappa et al., 1989; Bionaz et al., 2007; Bertoni et al., 2008). Tale situazione è causata dall’attivazione del sistema immunitario innato che determina il rilascio di citochine pro-infiammatorie (es. IL-1, IL-6, TNF-α) da parte principalmente di monociti-macrofagi (Elsasser et al., 1995 e Bertoni et al., 2000), a seguito dell’azione di molteplici fenomeni, tra i quali figurano alcune tipiche condizioni del periparto (es. traumi; stati di stress quali cambio di gruppo, strutture inadeguate, mungitura; anomalie digestive con assorbimento di lipopolisaccaridi). Una dimostrazione definitiva del coinvolgimento delle citochine proinfiammatorie nei fenomeni del periparto non esiste ancora sebbene il loro rilascio trovi conferma in due fatti: i) in una nostra esperienza abbiamo potuto constatare elevati livelli plasmatici di IL-6 e TNF-α prima del parto in assenza di qualsiasi sintomo patologico (Trevisi et al., 2009); ii) la somministrazione di citochine nel periparto (IFN-α, Trevisi et al., 2009 e TNF-α, Bradford et al., 2009) aggrava il tipico quadro infiammatorio di tale fase. Recentemente inoltre, abbiamo osservato che in gestazione il livello basale di tali citochine potrebbe giocare un ruolo sulla suscettibilità ai tipici eventi infiammatori che si verificano nel periparto (Trevisi et al., 2015). In ogni caso, appare molto probabile che gran parte degli effetti indesiderati nel periparto siano da ricollegare a citochine pro-infiammatorie, in quanto responsabili di una cascata di eventi che coinvolgono vari organi:
- a livello locale attivano la risposta infiammatoria, stimolando la liberazione di eicosanoidi (prostaglandine, leucotrieni e trombossani) tramite l’attivazione degli enzimi chiave di tale processo, la ciclo-ossigenasi e la lipo-ossigenasi (Annison et al., 1995);
- a livello del sistema nervoso centrale, inducono il rialzo termico e il calo di appetito (anoressia);
- a livello tissutale, aumentano il catabolismo, soprattutto quello del tessuto adiposo e muscolare;
- a livello epatico deviano le sintesi proteiche, con aumento di alcune proteine, dette proteine positive di fase acuta (+APP; es. aptoglobina, ceruloplasmina, siero amiloide A) e riduzione di altre, dette proteine negative di fase acuta (-APP; es. albumine, enzimi, “carriers” di vitamine ed ormoni, lipoproteine).
Una delle più frequenti conseguenze negative di tali modificazioni può essere la deposizione di trigliceridi nel fegato (Bertoni, 1996; Bradford et al., 2009), per l’inadeguata sintesi di lipoproteine (che sono delle –APP) necessarie ad immetterli nel flusso ematico. Pertanto un’intensa lipomobilizzazione concomitante ad uno stato infiammatorio, come avviene nell’immediato post-parto, aumenta notevolmente il rischio di steatosi epatica (Bertoni et al., 2004).
In ragione di ciò, le variazioni relative all’attività epatica, con gli inevitabili riflessi sulle APP ematiche, sono di grande utilità diagnostica. Infatti, le +APP da tempo sono utilizzate per rilevare la presenza di affezioni (Gruys et al., 1999; Murata et al., 2004). Alla luce di questo, le APP possono essere utili indicatori per segnalare la presenza di patologie sub-cliniche. A conferma di questo, il calo di ingestione pre-parto (Trevisi et al., 2002) è stato associato tanto ad un aumento delle +APP (figura 2b) quanto ad un anticipo del NEB, con conseguente lipomobilizzazione (aumento dei NEFA e dei corpi chetonici). Dopo il parto invece, l’andamento delle +APP non discrimina adeguatamente le bovine in relazione alla gravità delle affezioni avvenute (Bionaz et al., 2007; Bertoni et al., 2008), in quanto vi è generalmente un loro aumento, più o meno prolungato nel tempo, correlato anche allo stress del parto e ai relativi riaggiustamenti tissutali.
Ad ogni modo l’evento infiammatorio riscontrabile al parto non è negativo in sé, semmai sono gli effetti indesiderati, derivanti da eccessiva durata temporale, ampiezza o da risposta eccessiva (reiterazione) che possono preoccupare. Per questo motivo, appare più efficace valutare indicatori ematici che misurano le conseguenze del fatto infiammatorio, come le variazioni delle –APP ad esempio, piuttosto che indicatori della presenza di infiamazione (le +APP). La conferma è stata ottenuta classificando le bovine sulla base dell’andamento post-parto di alcune –APP (albumine, colesterolo quale indice delle lipoproteine e vitamina A quale indice della rispettiva proteina carrier) combinate in un indice complesso denominato Liver Activity Index (LAI; Trevisi et al., 2001). Le bovine con i livelli più elevati di LAI (quelle con minori conseguenze negative a livello epatico; Bertoni et al., 2008) hanno mostrato fatti infiammatori meno gravi (ovvero riduzione postpartale più rapida delle +APP), stress ossidativo meno marcato (minor innalzamento dei ROMs, metaboliti reattivi dell’ossigeno), minore incidenza di patologie unitamente alle migliori performance (più elevata produzione di latte e fertilità). Questo approccio è senz’altro utile per individuare anticipatamente i soggetti a rischio di ipofertilità che sono quelli che soffrono di patologie – anche subcliniche – in avvio di lattazione, ma indica soprattutto l’utilità di valutare i livelli delle –APP (oltre che delle +APP) nel periparto per stabilire le reali conseguenze dei fatti infiammatori subiti dalle bovine e la necessità di interventi terapeutici. Nonostante l’indubbia utilità delle informazioni fornite dall’indice LAI, questa misura è risultata essere onerosa in termini di tempo (almeno 3 prelievi di sangue per bovine nel primo mese di lattazione) e di costo. Oltre a ciò, il LAI non consente un paragone con animali di altri allevamenti poiché è basato sul confronto entro la popolazione monitorata.
La valutazione plasmatica della bilirubina totale è un indice estremamente utile nel postparto, infatti il suo aumento rappresenta l’incapacità del fegato ad esprimere il complesso enzimatico necessario alla sua escrezione. Anche la bilirubina riflette quindi la produzione di –APP. L’andamento di tale indice, associato a quello di altre –APP (albumine e lipoproteine), è stato utilizzato per calcolare un altro indice composto, denominato Liver Functionality Index (LFI; Bertoni et al., 2006), che ha finalità analoghe a quelle del LAI. Con l’LFI è possibile individuare precocemente i soggetti con le peggiori capacità di adattamento nel periparto e le peggiori performance in lattazione. Tale indice è più semplice da misurare (2 prelievi a 3 e 28 giorni di lattazione) e dà una risposta oggettiva della bovina controllata che consente confronti nel tempo e tra allevamenti diversi.
Recentemente è stato proposto un terzo indice denominato PIRI (Post-calving Inflammatory Response Index), che include 4 saggi legati alla risposta infiammatoria (aptoglobina, ovvero +APP, colesterolo e paraoxonasi, ovvero -APP) e dello stress ossidativo (ROMs) eseguiti con un solo prelievo tra 3 e 7 giorni di lattazione. Bovine con indice PIRI più basso (più elevata risposta infiammatoria) hanno manifestato un’ incidenza più elevata di patologie nel post parto, una maggiore lipomobilizzazione e concentrazione di corpi chetonici, una minore produzione di latte. Sebbene tale indice richieda ancora una validazione su ampia scala, appare potenzialmente uno strumento utile in allevamento per identificare, in fase preclinica, le tipiche affezioni del periparto, anche se non copre tutti problemi che possono insorgere tra la prima e la terza settimana di lattazione, che virtualmente sono ancora classificati entro il periodo di transizione.
Nel complesso, è ragionevole impiegare sia LFI che PIRI, procedendo a due prelievi di sangue a 3-7 e 28-30 giorni dal parto. Il primo prelievo sarà impiegato per calcolare PIRI e identificare prontamente le bovine con problemi subclinici. Il secondo prelievo sarà usato per calcolare LFI e identificare i soggetti con problemi di più tardiva insorgenza. Ciò dovrebbe consentire ai buiatri di anticipare i possibili trattamenti terapeutici del caso. Più in generale, va sottolineato che gli accertamenti di diagnostica precoce di cui sopra sono pienamente funzionali a più efficaci trattamenti terapeutici e ad una strategia complessiva di riduzione del consumo di antibiotici in allevamento (Trevisi et al., 2014).
Indici di funzione immunitaria
La bovina da latte nel periparto presenta una diminuita attività di alcune funzioni del sistema immunitario (Goff and Horst, 1997; Lacetera et al., 2005). In particolare, Goff and Horst (1997) riportano una diminuita attività fagocitaria dei neutrofili ed una ridotta attitudine dei linfociti a rispondere ai mitogeni e a produrre anticorpi, nella settimana prima ed in quella seguente il parto. Contemporaneamente, la bovina da latte manifesta variazioni della formula leucocitaria. Immediatamente dopo il parto si assiste infatti all’innalzamento dei neutrofili, spesso anche dei monociti, mentre i linfociti calano (Archetti e Ravarotto, 2002; Calamari et al., 2004). Tali variazioni determinano l’inversione della formula leucocitaria, con valori del rapporto neutrofili/linfociti oltre l’unità. Oltre a tale aspetto, sussiste in molte bovine un forte incremento delle normali concentrazioni di monociti del sangue, sotteso probabilmente ad una strategia di risposta omeostatica tuttora da definire. In questo contesto va anche ricordato che nonostante la riduzione di alcune funzioni immunitarie, dopo il parto vi è una marcata risposta infiammatoria a livello sistemico, ma una ridotta risposta flogistica periferica (Jahan et al., 2015), che suggeriscono la presenza di fattori di disregolazione piuttosto che di immunodepressione diffusa. Tale quadro va quindi definito caso per caso, per individuare i soggetti incapaci di adattarsi e meritevoli di interventi, che saranno tanto più efficaci quanto più mirati e tempestivi.
Indici immunologici predittivi in asciutta
Uno studio in stalla sperimentale (Trevisi et al., 2012) aveva evidenziato che taluni indici di infiammazione (IL-6, ceruloplasmina) sono evidenti anche nel periodo di asciutta di bovine considerate a rischio sulla base dell’indice LFI. Sulla base di tale indicazione è stato eseguito un esteso studio di caso/controllo su 80 bovine da latte pluripare appartenenti a 26 allevamenti, cui è stato prelevato il sangue a 4 e 1 settimana prima del parto (Amadori et al., 2015). Di tali bovine sono poi stati registrati tutti i casi clinici post parto e i trattamenti farmacologici utilizzati. I parametri lisozima e IL-6 hanno rivelato in asciutta una capacità di definire il rischio sanitario delle bovine da latte oggetto di studio. In particolare, le bovine da latte con livelli alterati di lisozima e/o IL-6 a 4 settimane dal parto hanno presentato un’incidenza significativamente più elevata di patologie nel periparto (P< 0,01). Le patologie più correlate a tali valori alterati sono state ritenzione di placenta, mastite, dislocazione dell’abomaso, diarrea e blocco ruminale, rischio di morte/riforma entro i primi 60 giorni post parto. I risultati confermano la possibilità che comuni stressori ambientali nel periodo di asciutta possano determinare un “imprinting” negativo sul sistema immunitario innato nella bovina da latte Frisona ad alta produzione. I dati confermano altresì la possibilità di utilizzare il periodo di asciutta per determinare utilmente il rischio sanitario delle bovine da latte e individuare così gruppi e soggetti a rischio. Infine, i risultati dimostrano che il destino della bovina da latte nel periodo di transizione si decide molto spesso in asciutta, periodo purtroppo trascurato da molti allevatori in termini di cure ambientali, investimenti e monitoraggio sanitario.
I costi di una transizione a rischio
I costi di una fase di transizione problematica sono ingenti, ma non sempre è facile stimarne l’entità. Il primo costo riguarda l’uso di farmaci e la conseguente eliminazione di latte a causa della contaminazione con principi attivi. Un secondo riguarda la mancata produzione che si verifica quando le bovine sono affette da una qualsiasi affezione. Tale perdita non è sempre evidente nel primo mese di lattazione, specie in bovine ad alta potenzialità produttiva, in quanto, almeno in parte, colmata dal maggior ricorso alle riserve corporee. E’ opportuno ricordare che la riduzione di un kg/die di latte al picco di produzione comporta la perdita di circa 200 kg sui canonici 305 giorni di lattazione. Un terzo costo, ancor più difficile da quantificare, riguarda le conseguenze negative a carico della qualità del latte, essenzialmente per la riduzione della resa casearia (titolo lipidico e proteico), del tenore caseinico e del peggioramento delle prerogative casearie (attitudine alla coagulazione e acidità titolabile); tutti aspetti che hanno un riflesso negativo sul pagamento del latte a qualità. Un quarto rilevante costo riguarda l’aumentata frequenza delle affezioni nei soggetti che hanno già manifestato una transizione problematica, nonché del peggioramento delle performance riproduttive (Bertoni et al., 2008) e della longevità. Infine non va trascurato il costo del personale dedito all’assistenza e l’inevitabile complicazione della routine aziendale.
In uno studio di parecchi anni fa, Bartlett et al. (1986) quantificarono tali costi e/o mancati redditi per bovine affette da alcune tipiche patologie peripartali (es. metriti, chetosi, dislocazioni), in 417-835 euro per lattazione (a prezzi correnti). La situazione è indubbiamente molto differente in relazione al contesto produttivo in cui si opera. In una nostra recente indagine, condotta in due allevamenti caratterizzati da un buon management, il costo dei soli trattamenti farmacologici, limitatamente al primo mese di lattazione, è risultato di circa 75 euro/bovina. Tuttavia, l’aspetto più interessante è relativo al fatto che i costi sono risultati correlati al predetto indice di funzionalità epatica (LFI), infatti sono risultati tre volte superiori nelle bovine che presentavano i peggiori livelli di LFI rispetto a quelle con indice elevato (114 vs 39 euro/bovina; Trevisi et al., 2014). Questo dato suggerisce che riuscire ad individuare tempestivamente le malattie metaboliche ed infettive nel periparto potrebbe avere enormi benefici sia per il benessere delle bovine che per l’efficienza economica degli allevamenti.
Implicazioni e prospettive
E’ indubbio che, nonostante i notevoli e recenti sforzi finalizzati a migliorare la gestione della fase di transizione della lattifera ad elevata potenzialità produttiva, i risultati non sono ancora da ritenere soddisfacenti. La conferma è rappresentata dall’ancora eccessiva frequenza di affezioni cliniche e subcliniche, metaboliche ed infettive, che si verificano nel periparto, con conseguenze gravi sia per lo stato di salute e benessere delle bovine che per la sostenibilità economica degli allevamenti moderni. Le attuali tecnologie, unitamente ad una migliorata comprensione dei meccanismi fisio-patologici con cui si scatenano certe affezioni, consentono di monitorare con più attenzione le bovine in questo cruciale periodo, permettendo l’individuazione di sintomi patologici in una fase più precoce. Dalle nostre indagini risulta infatti evidente che molti indici fisiologici (temperatura corporea, ingestione degli alimenti, attività ruminale, markers dell’infiammazione, dello stress ossidativo e dello stato energetico) inizino a mostrare importanti variazioni prima del parto stesso. Tale dato è in accordo con gli indici predittivi in asciutta (lisozima e IL-6) più sopra ricordati. Gli eventuali interventi terapeutici in caso di affezioni devono essere assicurati con la massima tempestività per ridurre le conseguenze negative sulle bovine ed i costi diretti ed indiretti per gli allevatori.
In relazione a quanto sopra descritto, resta tuttavia primario l’obiettivo di realizzare in allevamento i sistemi di profilassi possibili (controlli termografici, di ingestione, BCS, ruminazione, visita ginecologica post parto, parametri ematici relativi a metabolismo energetico, stress ossidativo e stato infiammatorio) nella cornice di Requisiti Minimi di controllo e prevenzione che contraddistinguano Buone Pratiche di Allevamento (vedi Regolamento 852/2004/CE sull’igiene dei prodotti alimentari). Tali interventi devono collocarsi nell’ambito di una robusta cornice di impiantistica zootecnica che assicuri il rispetto di fondamentali parametri di benessere animale (vedi figure 1, 2 ,3) e di piani di profilassi aziendali che includano almeno i seguenti aspetti (Trevisi et al., 2011):
- sanitari: piani vaccinali e antiparassitari;
- gestionali: cure podali, manipolazioni degli animali;
- alimentari: alimentazione equilibrata per apporto energetico, rapporto energia/massa, percentuale e tipologia di fibra, integrazioni minerali;
- riproduttivi: riconoscimento tempestivo dei calori e diagnosi precoce di gravidanza.
Questi interventi dovrebbero rientrare in Procedure Operative Standard. E’ infatti sulla corretta e sinergica applicazione di questi interventi che si può fondare “la lattazione di successo”: bovine in buone condizioni di benessere e con ottime performance, limitato uso di farmaci, quindi produzioni più sicure per il consumatore e di maggiore qualità, allevatori e tecnici più soddisfatti. Infine, non si può ignorare il fatto che i margini economici per gli interventi di cui sopra debbano essere costruiti sulla base di un adeguato riconoscimento del merito degli allevatori in termini di sicurezza alimentare nella produzione primaria. E’ vitale pertanto che agli allevamenti migliori in termini di biosicurezza e di consumo degli antibiotici sia riconosciuto un valore aggiunto sul prezzo di vendita del latte. Tale misura potrebbe costituire uno strumento formidabile di riconoscimento e valorizzazione delle filiere lattiero-casearie nazionali in un periodo contrassegnato da incertezze e timori relativi alla cancellazione delle quote latte e all’uso ventilato del latte in polvere per la produzione di formaggi.
Bibliografia
Amadori M., Fusi F., Bilato D., Archetti I.L., Lorenzi V., Bertocchi L. 2015. Disease risk assessment by clinical immunology analyses in periparturient dairy cows. Research in Veterinary Science (http://www.sciencedirect.com/science/article/pii/S0034528815300102).
Annison A.C., Lee J.C., Eugui E.M. 1995. Pharmacological regulation of the production of the proinflammatory cytokines TNF-α _and IL-1b. In “Human cytokines: their role in disease and therapy”. Ed. Blackwell Science, Oxford-England. Pp 689-697.
Archetti I., Ravarotto L. 2002. Esame emocromocitometrico e formula leucocitaria mediante strumento Cell-Dyn 3500®. In: La valutazione del benessere nella specie bovina. Amadori M. & Archetti I. (a cura di). Ed. Fondaz. Iniz. Zooprof. Zoot., Brescia: 77-83.
Bertoni G., Trevisi E. 1992. Il body condition score (BCS) per valutare lo stato nutrizionale delle lattifere. Praxis Vet., 13(2): 5-8.
Bertoni G., Trevisi E., Bani P. 1994. Metabolic effects of two different lapses without concentrate in early lactating dairy cows. Livestock Prod. Sci., 39: 139-140.
Bertoni G. 1996. La lipidosi epatica nella bovina lattifera: aspetti nutrizionali. Atti Soc. Ital. Buiatria, 28:61-75.
Bertoni G., Trevisi E. 1997. Le principali malattie metaboliche delle lattifere e la loro prevenzione. L’Informatore Agrario, 53 (suppl. n°47):1-34.
Bertoni G., Piccioli Cappelli F. 1999. Guida all’interpretazione dei profili metabolici. A.S.P.A. Commissione di studio “Valutazione dell’assetto endocrino metabolico degli animali in produzione zootecnica”. Ed. Università degli Studi di Perugia.
Bertoni G., Trevisi E., Calamari L., Bionaz M. 2004. The inflammation could have a role in the liver lipidosis occurrence in dairy cows. In ”Production diseases in farm animals” 12th International Conference (July 19-22, 2004, East Lansing, Michigan, USA). Ed Joshi N.P. and Herdt T.H., Wageningen Academic Publ., Wageningen, Pp 157-158.
Bertoni G., Trevisi E., Ferrari A.R., Gubbiotti A. 2006. The dairy cow performances can be affected by inflammations occurring around calving. 57th EAAP Meeting, 17-20 Sept., Antalya, Turkey. Pp 325.
Bertoni G., Trevisi E., Han X., Bionaz M. 2008. Effects of Inflammatory Conditions on Liver Activity in the Puerperium and Consequences for Performance in Dairy Cows. J. Dairy Sci. 91:3300-3310.
Bionaz M., Trevisi E., Calamari L., Librandi F., Ferrari A., Bertoni G. 2007. Plasma Paraoxonase, Inflammatory Conditions, Liver Functionality and Health Problems in Transition Dairy Cows. J. Dairy Sci., 90:1740-1750.
Bradford B.J., Mamedova L.K., Minton J.E., Drouillard J.S., Johnson B.J. 2009. Daily Injection of Tumor Necrosis Factor-α _Increases Hepatic Triglycerides and Alters Transcript Abundance of Metabolic Genes in Lactating Dairy Cattle. J. Nutr. 139:1451–1456.
Calamari L., Bionaz M., Trevisi E., Bertoni G. 2004. Preliminary study to validate a model of animal welfare assessment in dairy farms. Reprints 5th Congr. EURSAFE– Science, Ethics & Society, Ed. Johan De Tavernier & Stefan Aerts, Katholieke Uni. Leuven. Pp. 38-42.
Cappa V., Trevisi E., Bertoni G. 1989. Variazioni ematiche e produttive nel 1° mese di lattazione in bovine di allevamenti con o senza problemi “post-partum”. Zoot. Nutr. Anim., 15: 645-660.
Chase L.E. 1996. Management in the transition cows. Prooc. of The Penn Annual Conference: http://cahpwww.nbc.upenn.edu/pc96/managetrancow.html
Drackley J.K. 1999. Biology of dairy cows during the transition period: the final frontier? J. Dairy Sci. 82:2259-2273.
Duffield T. 2003. Minimizing subclinical metabolic diseases. Proceedings of “Tri-State Dairy Nutrition Conference”. Fort Wayne, Indiana. Pp. 1-13.
Elsasser T. H., Steele N. C., Fayer R. 1995. Cytokines, stress, and growth modulation. In: Myers, M. J. and M. P. Martaugh (editors), Cytokines in animal health and disease. Marcel Dekker, Inc., New York.
Elsasser T.H., Klasing K.C., Filipov N., Thompson F. 2000. The metabolic consequen-ces of stress: target for stress and priorities of nutrient use. In: Moberg, G.P. and J.A., Mench (editors), The biology of animal stress. CABI Publishing, New York, USA. Pp. 77-110.
Formigoni A., Trevisi E. 2003. Transition cow: interaction with fertility. Veterinary Research Communication, 27 (Suppl.1):143-152.
Galligan D.T., Ferguson J.D. 1996. Prevention and treatment of postpartum diseases. Proc. of The Penn Annual Conference: http://cahpwww.nbc.upenn.edu/pc96/prvntrtppd.html
Gallo, P.M., Gallucci, S., 2013. The dendritic cell response to classic, emerging, and homeostatic danger signals. Implications for autoimmunity. Front. Immunol. 4, 138.
Goff J.P., Horst R.L. 1997. Physiological changes at parturition and their relationship to metabolic disorders. J. Dairy Sci. 80:1260-1268
Gruys E., Toussaint M.J., Landman W.J., Tivapasi M., Chamanza R., VanVeen L. 1999. Infection, inflam-mation and stress inhibit growth. Mechanisms and non-specific assessment of the processes by acute phase proteins. In: Th. Wensing (ed.) Production diseases in farm animals, Wageningen Pers. Pp 72-87.
Grummer, R.R. 1993. Etiology of lipid-related metabolic disorders in periparturient dairy cows. J Dairy Sci. 76:3882.
Grummer, R.R. 1995. Impact of changes in organic nutrient metabolism on feeding the transition dairy cow. J. Anim. Sci. 73:2820.
Ingvartsen K.L. et al., 2003. On the relationship between lactational performance and health: is it yield or metabolic imbalance that causes diseases in dairy cattle ? Livestock Production Science 83: 277-308.
Ingvartsen KL, Moyes K. 2013. Nutrition, immune function and health of dairy cattle. Animal. 2013 Mar;7 Suppl 1:112-22. doi: 10.1017/S175173111200170X.
Jahan N., Minuti A., Trevisi E. 2015. Assessment of immune response in periparturient dairy cows using ex vivo whole blood stimulation assay with lipopolysaccharides and carrageen skin test. Veterinary Immunology and Immunopathology 165:119-126.
Jordan. E.R., Fourdraine R.H. 1993. Characterization of the management practices of the top milk producing herds in the country. J. Dairy Sci. 76:3247.
Lacetera N., Scalia D., Bernabucci U., Ronchi B., Piarazzi D., Nardone A. 2005. Lymphocyte functions in overconditioned cows around parturition. J. Dairy Sci. 88:2010-2016.
LeBlanc S.J., Lissemore K.D., Kelton D.F., Duffield T.F., Leslie K.E. 2006. Major advances in disease prevention in dairy cattle. J. Dairy Sci. 89:1267-1279.
Murata, H., Shimada, N., Yoshioka, M., 2004. Current research on acute phase proteins in veterinary diagnosis: an overview. Vet. J. 168:28-40.
Oltenacu P.A. and Broom D.M. 2010. The impact of genetic selection for increased milk yield on the welfare of dairy cows. Animal Welfare 19, 39-49.
Santos A., 2008. Utilizing functional feed ingredients for pre-harvest food safety strategies. 59th Annual Meeting of EAAP. Vilnius, Lithuania. Pp. 38.
Schirmann, K., von Keyserlingk M.A.G., Weary D.M., Veira D.M. and Heuwieser W. 2009. Technical note: validation of a system for monitoring rumination in dairy cows. J. Dairy Sci. 92:6052-6055.
Smith B., Risco C., Benzaquen M., Melendez P. 2006. Monitoring health and looking for sick cows. Proceeding 3rd Florida and Georgia Dairy Road Show. www.milkproduction.com
Soriani N., Trevisi E., Calamari L. 2012. Relationships between rumination time, metabolic conditions and health status in dairy cows during the transition period. J. Anim. Sci. 90:4544-4554.
Trevisi E., Calamari L., Bertoni G. 2001. Definition of a liver activity index in the transition dairy cow and its relationship with the reproductive performance. 10th Int. Symp. of Veterinary Laboratory Diagnosticans, 4-7 July, Salsomaggiore (Italy). Pp. 118-119.
Trevisi E., Han X.T., Piccioli-Cappelli F., Bertoni G. 2002. Intake reduction before calving affects milk yield and metabolism in dairy cows. 53rd Annual Meeting EAAP, Cairo, Egypt. Pp. 54.
Trevisi E., Gubbiotti A., Bertoni G. 2007. Effects of inflammation in peripartum dairy cows on milk yield, energy balance and efficiency. In: Energy and Protein Metabolism and Nutrition. EAAP publication No. 124. Wageningen Academic Publishers. Pp 395-396.
Trevisi E., Amadori M., Bakudila A.M., Bertoni G. 2009. Metabolic changes in dairy cows induced by oral, low-dose interferon-alpha treatment. J. Anim. Sci. 87:3020-3029.
Trevisi E., Zecconi A., Bertoni G., Piccinini R. 2010. Blood and milk immune and inflammatory responses in periparturient dairy cows showing a different liver activity index J. Dairy Research 77: 310-317.
Trevisi E., Amadori M., Archetti I., Lacetera N., Bertoni G., 2011. Inflammatory response and acute phase proteins in the transition period of high-yielding dairy cows. In: “Acute Phase Protein / Book 2” Ed. F. Veas, InTech Rijeka, Croatia; Pp 355-380.
Trevisi, E., Amadori, M., Cogrossi, S., Razzuoli, E., Bertoni, G., 2012. Metabolic stress and inflammatory response in high-yielding, periparturient dairy cows. Research in Veterinary Science 93, 695-704.
Trevisi E, Zecconi A, Cogrossi S, Razzuoli E, Grossi P, Amadori M. 2014. Strategies for reduced antibiotic usage in dairy cattle farms. Res Vet Sci. 96(2):229-33.
Trevisi E., Jahan N., Ferrari A., Minuti A. 2015. Pro-inflammatory cytokine profile in dairy cows: consequences for new lactation. Ital. J. Anim. Sci., 14:285-292.
Autori: Massimo Amadori a ed Erminio Trevisi b
a Laboratorio di Immunologia Cellulare, Istituto Zooprofilattico Sperimentale della Lombardia e dell’Emilia-Romagna, via A. Bianchi, 9 – 25124 Brescia
b Istituto di Zootecnica – Facoltà di Scienze Agrarie, Alimentari ed Ambientali – Università Cattolica del S. Cuore, via Emilia Parmense, 84 -29123 Piacenza