La chetosi è una malattia metabolica tipica del post-parto caratterizzata da un aumento patologico dei corpi chetonici nel sangue e nei fluidi organici. I corpi chetonici sono un normale prodotto del catabolismo dei lipidi; vengono prodotti in quantità piuttosto limitata ma in alcune condizioni patologiche o parafisiologiche questa può aumentare in modo considerevole provocando la patologia. La causa principale della chetosi è l’equilibrio energetico negativo che la bovina sperimenta nel periodo di transizione. Questa condizione dipende dal fatto che la perdita di energia legata allo sviluppo del feto nell’ultima fase della gravidanza e alla montata lattea dopo il parto, non viene bilanciata dall’energia introdotta nell’organismo attraverso l’alimentazione.
Alcune bovine, soprattutto quelle in sovrappeso, presentano una insulino-resistenza più o meno marcata. Questa è una condizione caratterizzata da una riduzione del numero o dell’affinità dei recettori per l’insulina a livello cellulare. Si assiste quindi ad una difficoltà da parte delle cellule nell’utilizzo del glucosio che, per poter attraversare la membrana cellulare, ha necessariamente bisogno dell’interazione recettore – insulina. Tale interazione permette l’apertura dei canali del glucosio, proteine trans-membrane, che lasciano entrare le molecole glucidiche all’interno delle cellule. L’insulino-resistenza è caratterizzata quindi da una glicemia normale, o addirittura aumentata, e contemporaneamente da una condizione di deficit energetico a livello cellulare poiché il glucosio non riesce ad entrare nel citoplasma per essere utilizzato come fonte energetica.
Il deficit energetico viene tamponato inizialmente utilizzando le scorte di glicogeno che però sono piuttosto limitate e, ben presto, l’organismo ricorre all’utilizzo dei trigliceridi di deposito (nel tessuto adiposo). La lipolisi innescata dal deficit energetico determina il passaggio in circolo di acidi grassi non esterificati (NEFA) che vengono utilizzati, soprattutto nel fegato, come combustibile per il ciclo di Krebs. Le aumentate richieste di energia, contemporaneamente, esaltano il processo della gluconeogenesi necessario per rifornire l’organismo di glucosio. L’ossalacetato, molecola chiave del ciclo di Krebs, è una delle principali molecole glucogeniche e viene sottratto in grande quantità dai mitocondri per essere utilizzato per la sintesi di glucosio. Il ciclo di Krebs viene fortemente inibito per carenza di ossalacetato e il processo del catabolismo dei NEFA rallenta provocando un pericoloso aumento di acetil-CoA. L’acetil-CoA in eccesso viene trasformato in corpi chetonici che possono così abbandonare gli epatociti ed essere catabolizzati da altri tessuti (soprattutto muscoli e sistema nervoso). Quando questo processo va fuori controllo la quantità di corpi chetonici nel sangue e nei fluidi corporei aumenta provocando la chetosi.
Compreso il meccanismo patogenetico diventa piuttosto agevole impostare una strategia terapeutica efficace. Il punto cardine di una terapia ragionata della chetosi prevede innanzitutto il ripristino della glicemia. In questo modo infatti l’ossalacetato rimarrà all’interno dei mitocondri perché il glucosio verrà fornito dall’esterno.
Somministrazione endovenosa di glucosio
Generalmente si utilizza l’infusione endovenosa di glucosio a varie concentrazioni. Il dosaggio raccomandato dal testo “Medicina interna e chirurgia del bovino” è di 150 – 200g a capo in 1 – 2 somministrazioni giornaliere oppure 500 – 1500 g in perfusione continua goccia a goccia.
In alcune situazioni particolari, come ad esempio nelle vacche sovrappeso o nelle quali il dosaggio ematico della glicemia fosse elevato, è lecito sospettare un certo grado di insulino-resistenza. In questo caso è conveniente somministrare fruttosio anziché glucosio. A differenza del glucosio, che ha bisogno dell’insulina per poter entrare all’interno delle cellule, il fruttosio supera la membrana cellulare per diffusione semplice, e bypassa quindi l’eventuale difficoltà determinata da una condizione di insulino-resistenza.
È possibile somministrare glucosio o fruttosio endovena per più giorni (generalmente sono sufficienti 3 giorni di terapia) fino al ritorno della chetonemia nei valori fisiologici. Una seconda strategia prevede, dopo una prima somministrazione endovenosa di glucosio o fruttosio, di continuare con la somministrazione orale di sostanze che vengono utilizzate dal bovino come precursori di glucosio.
Somministrazione orale di molecole iperglicemizzanti
Le principali sostanze utilizzate per la terapia della chetosi attraverso la via orale sono:
- Glicole propilenico: il dosaggio raccomandato dal testo “Medicina interna e chirurgia del bovino” è di 100 – 150 g a capo in 1 – 2 somministrazioni giornaliere.
- Glicerolo: il dosaggio raccomandato è di 500 g a capo in 1 somministrazione giornaliera.
- Propionato di sodio e di calcio: il dosaggio raccomandato dal testo “Medicina interna e chirurgia del bovino” è di 100 g a capo in 2 somministrazioni giornaliere.
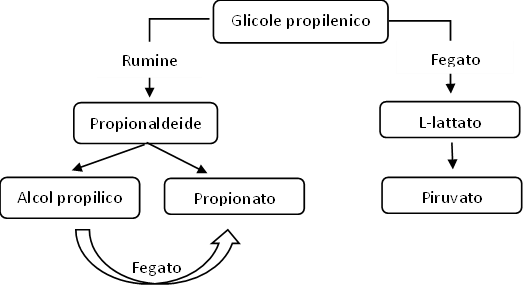
Il glicole propilenico è senza dubbio la molecola maggiormente utilizzata in buiatria per i suoi effetti glucogenici e di riduzione dei NEFA e di corpi chetonici. Occorre distinguere due meccanismi catabolici a cui è sottoposto il glicole propilenico, in parte nel rumine e in parte nel fegato. A livello ruminale, il glicole propilenico viene convertito a propionaldeide attraverso una reazione di disidratazione (sottrazione di una molecola di acqua). La propionaldeide, a seconda che si comporti da donatore o accettore di elettroni, viene convertita per circa il 50% in alcol propilico con una reazione di riduzione (accettore di elettroni) e il restante 50% in acido propionico (propionato) con una reazione di ossidazione (donatore di elettroni). Dal rumine, attraverso la vena porta, il propionato e l’alcol propilico arrivano al fegato. Il propionato si inserisce direttamente nella via metabolica della gluconeogenesi riportata in figura 2, mentre l’alcol propilico deve prima essere ossidato a propionato. Il glicole propilenico non viene più rilevato nel rumine dopo circa 3,5 ore dall’assunzione. La quota di glicole non convertita a propionaldeide viene assorbita nel circolo ematico e attraverso la vena porta arriva al fegato. L’uptake epatico di glicole propilenico tal quale è tuttavia molto basso (8% – 19%) e rimane nel sangue per parecchie ore prima di essere completamente metabolizzato.
Nel fegato il glicole propilenico viene principalmente convertito in L-lattato e non in glucosio. Il lattato viene ossidato a piruvato dalla lattato deidrogenasi, entra quindi nei mitocondri dove viene carbossilato ad ossalacetato, uno dei principali substrati per la gluconeogenesi e molecola chiave del ciclo di Krebs.
Figura 1. Catabolismo del glicole propilenico.
Il glicole propilenico è generalmente molto ben tollerato ed efficace a patto che il fegato funzioni correttamente. Nei bovini con una funzionalità epatica non ottimale andrebbe usato con cautela e non andrebbe somministrato ai bovini con un’insufficienza epatica conclamata. I metaboliti più rappresentativi, l’alcol propilico e il lattato possono infatti peggiorare una funzionalità epatica già precaria.
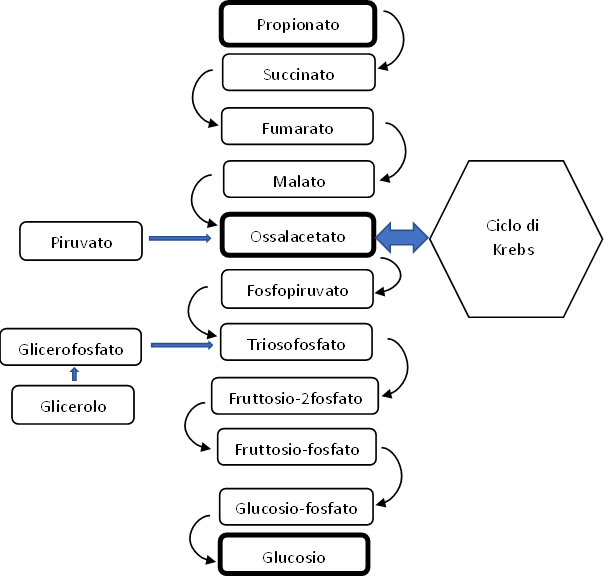
Il glicerolo e il propionato di sodio e di calcio sono delle molecole utilizzate in buiatria in sostituzione del glicole propilenico. Fungono da precursori del glucosio inserendosi nella via metabolica riportata in figura 2.
Figura 2. Relazione tra gluconeogenesi e ciclo di Krebs. Punti di ingresso delle varie sostanze usate per la terapia della chetosi.
Alla terapia di base appena descritta si associa spesso una terapia di supporto che prevede l’utilizzo di numerose sostanze ad attività farmacologica.
Vitamine del complesso B
Ben quattro vitamine del gruppo B sono coinvolte nella deidrogenazione e decarbossilazione del piruvato ad Acetil-CoA. Queste sono:
- La vitamina B1 (tiamina) è un precursore del coenzima tiamina pirofosfato (TPP).
- La vitamina B2 (riboflavina) è necessaria per numerose reazioni catalizzate dalle flavoproteine (FAD).
- La vitamina B3 (niacina) (il suo ammide è la nicotinammide o vitamina PP) è un componente essenziale di due molecole coenzimatiche, il NAD e il NADP.
- La vitamina B5 (acido pantotenico) è un componente del coenzima-A che interviene in numerose reazioni del metabolismo energetico:
- sintesi dell’acido citrico per condensazione del coenzima-A con l’ossalacetato,
- sintesi dell’acetilcolina attraverso l’acetilazione della colina,
- sintesi dei corpi chetonici,
- ossidazione degli acidi grassi,
- decarbossilazione dei chetoacidi, con formazione di succinil-CoA che entra nel ciclo di Krebs.
Vitamina B12
La vitamina B12 (cianocobalamina) si trova in diversi prodotti epatoprotettori e antichetosici. Svolge numerose funzioni ma per quello che ci riguarda interviene in due processi:
- la conversione di metilmalonil-CoA in succinil-CoA;
- la conversione della cisteina in metionina.
Carnitina
Svolge una funzione essenziale per il trasporto degli acidi grassi e degli acetili rispettivamente all’interno e all’esterno dei mitocondri, contenendo così la produzione eccessiva di corpi chetonici.
Acido tioctico
Interviene come coenzima nel metabolismo glucidico. Ha una potentissima attività antiossidante che si esplica attraverso l’eliminazione delle specie reattive all’ossigeno (ROS). Le proprietà antiossidanti sono dovute alla presenza di un ponte disolfuro che si comporta da accettore di elettroni.
Acetilmetionina
È un composto acetilato dell’aminoacido metionina. Svolge la sua attività antichetosica dopo che è stato trasformato in cisteina e α-chetobutirrato. La cisteina viene utilizzata per la sintesi del glutatione che ha una marcata attività antiossidante, mentre l’α-chetobutirrato, convertito negli epatociti a succinil-coA, rientra nel ciclo di Krebs dove segue la via Succinato – Fumarato – Malato – Ossalacetato (figura 2).
Amminoacidi glucogenici
Sono amminoacidi che possono essere precursori del glucosio in quanto convertiti a piruvato o in intermedi del ciclo di Krebs:
- Alanina e glicina che sono convertiti a piruvato.
- Arginina e acido glutammico che sono convertiti a α-chetoglutarato.
- Treonina: convertita a succinil-CoA.
- Aspartato: convertito ad ossalacetato.
La lisina non è un amminoacido glucogenico poiché è totalmente incapace di fornire atomi di carbonio alla sintesi del glucosio ma è un precursore della carnitina per cui viene utilizzato come principio attivo di alcuni prodotti antichetosici.
Acido mefepronico
L’acido mefepronico è una sostanza con un’attività agonista dei recettori nucleari Peroxisome Proliferators-Activated Receptors (PPARs), e promuove la β-ossidazione perossisomiale e la gluconeogenesi a livello epatico. Viene usato per contrastare la steatosi epatica e la chetosi sfruttando i meccanismi precedentemente enunciati per supportare l’attività epatica. Il dosaggio raccomandato nel foglietto illustrativo del prodotto commerciale è di 50 grammi per capo.
Menbutone
Il menbutone viene utilizzato come terapia collaterale della chetosi per la sua spiccata funzione coleretica in quanto favorisce la produzione e secrezione della bile sostenendo la funzionalità del fegato. Il dosaggio raccomandato nel foglietto illustrativo del prodotto commerciale è di 1,5 – 5 grammi/capo a seconda del peso.
Corticosteroidi
La somministrazione parenterale di glicocorticoidi talvolta può rendersi utile per il loro potente effetto iperglicemizzante e di riduzione della produzione lattea; in questo modo contribuisce a contenere l’equilibrio energetico negativo. Tuttavia, occorre sempre valutare con attenzione il loro utilizzo a causa dei numerosi effetti collaterali:
- Favoriscono la lipolisi
- Inibiscono la produzione di insulina
- Hanno un effetto immunosoppressivo dopo somministrazioni ripetute (> 3 giorni)
Il dosaggio raccomandato dal testo “Medicina interna e chirurgia del bovino” è di 10 – 30 mg di desametasone per capo.
Insulina
La somministrazione parenterale di insulina è riportata come terapia collaterale della chetosi in quanto favorisce l’utilizzo di glucosio da parte delle cellule e svolge una spiccata attività antilipolitica. È necessario somministrarla insieme all’infusione lenta, goccia a goccia, di soluzione glucosata per contenere il potente effetto ipoglicemizzante. Il dosaggio raccomandato dal testo “Medicina interna e chirurgia del bovino” è di 200 mg s.c. della formulazione depot (insulina zinco-protamina).
La chetosi è una delle principali malattie metaboliche della bovina da latte. Si può prevenire con un corretto management del periodo di transizione ma, in particolari condizioni, può esprimersi in allevamento con un’incidenza anche molto elevata e il ricorso alla terapia diventa una necessità. La conoscenza dei meccanismi patogenetici è essenziale per la costruzione di una strategia terapeutica efficace che permetta alle bovine malate di ritornare il più velocemente possibile ad una condizione di salute e di benessere.








Scrivi un commento
Devi accedere, per commentare.